编者按:早期肺癌的治疗目标是治愈,基于多学科讨论的局部治疗(如手术和放疗)以及全身性治疗能进一步提高患者治愈的可能性。最新发表于Nature Reviews Clinical Oncology上的一篇综述详细阐述了早期肺癌治疗的热点问题以及非转移性肺癌全身性治疗临床研究的当前现状以及未来发展趋势。
在过去的60年中,非转移性肺癌全身性治疗的发展受到疾病异质性、患者合并症以及缺乏安全、耐受性良好且疗效可观的治疗药物等等多种因素的限制。与乳腺癌以及结肠癌患者相比,肺癌确诊患者平均年龄更大且主要为烟民,伴有肺气肿以及心脏病的可能性较高,这就导致了肺癌相关术式不仅带来了较高的全因死亡率,且患者耐受性较差。此外,这些因素也导致了患者对细胞毒药物的耐受性较低,而细胞毒药物在过去的几十年中一直是这部分患者的主要治疗药物。
随着吸烟率的降低、肺癌筛查意识的提高以及术前分期技术(18F-FDG PET/CT以及脑部MRI)的改进,肺癌患者的人口统计学特征正在不断发生改变。随着手术技术的提高,单纯依靠手术治疗的患者生存率在不断提高,且术后发病率降低。与此同时,放疗技术的改善,提高了靶区适形度并且显著降低了放疗毒性。此外,质子治疗以及MRI引导放疗技术的应用也进一步提高了放射治疗的疗效。在全身性治疗方面,随着靶向TKI类药物以及免疫检查点抑制剂的不断问世,转移性NSCLC患者的治疗药物大大扩充(目前FDA批准用于晚期肺癌治疗的药物如图1)。这与非转移性NSCLC当前有限的治疗药物选择形成了鲜明的对比。

图1:转移性和非转移性NSCLC的药物治疗
新型治疗药物在晚期肺癌中的成功,为这些药物扩大应用于非转移性肺癌患者,从而降低复发风险并提高治愈几率带来了可能。
非转移性NSCLC是否进行胸外科手术取决于肿瘤范围、病灶与周围组织的结构(是否技术可切除)以及基于患者生存质量的手术范围考量。若肿瘤无法完全切除或患者不适于接受手术,可转为根治性放疗等非手术手段进行管理。目前一些中心的研究结果显示,细胞毒药物新辅助化疗可将临界可切除的NSCLC转化为可切除NSCLC,尽管这种方案尚未被认为是标准治疗策略,但未来有望被用于非转移性NSCLC的治疗提高疗效。
不可切除患者的治疗选择:绝大多数不可手术Ⅰ/Ⅱ期、淋巴结阴性的NSCLC患者,标准治疗为根治性立体定向放射治疗(SBRT),生物有效剂量≥100 Gy。通过这种方法,原发肿瘤的长期局部控制率可达90%~95%,淋巴结和全身无进展生存率可达70%~80%。此外,对于不可切除、局部晚期、淋巴结阳性(ⅡB-ⅢC期)NSCLC患者而言,其标准治疗为根治性同步放化疗(cCRT,通常总剂量为60-66Gy/30-33fr),后续接受1年的度伐利尤单抗治疗。在2018年之前,不可切除、局部晚期NSCLC的标准治疗为cCRT(总放射剂量为60Gy/30fr)。PACIFIC研究证实了cCRT(包含至少两个周期的含铂双药化疗,放疗总剂量为54-66Gy)后续以度伐利尤单抗免疫治疗能够提高患者近11个月的中位无进展生存以及约18.4个月的中位总生存,为这部分患者的治疗建立了新的标准。
基于cCRT后免疫治疗的成功,多项研究对不可切除NSCLC中免疫治疗的应用进行进一步的探索。我们知道,就算是Ⅰ期的NSCLC患者,仍然存在20%~30%的进展或死亡风险。对于淋巴结阴性的Ⅰ期的NSCLC患者而言,根治性SBRT后辅助免疫治疗的有何价值?辅助免疫治疗的持续时间应为多长?相对SBRT免疫治疗应何时开始?纳武利尤单抗与伊匹木单抗双药免疫治疗联合cCRT疗效如何?这些都是未来值得探索的方向。而除免疫治疗方面的探索外,EGFR突变NSCLC患者根治性cCRT后靶向治疗药物如奥希替尼的应用也是目前的探索热点。此外,放射治疗技术(如质子治疗)的不断进步及其与全身性治疗的联合也有望进一步降低放疗相关的毒副作用。
可切除患者的全身性治疗:超过50%的NSCLC患者在单纯手术治疗后复发。在可切除的患者治疗中,最准确的预后因素为患者的病理分期。多项随机对照研究表明,成功手术后的Ⅰ-Ⅲ期NSCLC患者术后接受以顺铂为基础的方案能够显著降低死亡风险。相关meta分析表明,四个周期的以顺铂为基础的双药化疗方案对比单纯手术能够降低病理诊断Ⅱ-Ⅲ期NSCLC患者20%的死亡风险。而在相关专家共识的支持下,存在顺铂禁忌症的患者(如听力下降或肾功能不全),使用卡铂进行替代也是临床常见的做法。除此之外,部分前瞻性研究显示,在顺铂辅助治疗方案中增加其他作用机制的药物,如抗血管生成抑制剂、肺癌抗原靶向性疫苗等并没能显著改善患者的生存结果。

图2:非转移性NSCLC辅助治疗正在进行的Ⅲ期研究
除了术后辅助化疗外,在术后靶向或免疫治疗探索方面,也有诸多进展。目前绝大多数针对非转移性NSCLC辅助治疗的新药研究方案均加入以铂类药物为基础的化疗,但是目前这些辅助治疗研究尚缺乏成熟的数据。ADAURA研究探索了完全切除的NSCLC患者在完成标准辅助化疗后接受奥希替尼或安慰剂辅助治疗3年的疗效与安全性。研究结果显示,接受手术切除的Ⅱ-Ⅲ期EGFR突变NSCLC患者的无病生存期(DFS)显著改善(HR=0.17;95%CI 0.12-0.23)。ADAURA是首个基于生物标志物进行精准治疗选择并预期改变可切除肺癌标准范式的辅助治疗研究。
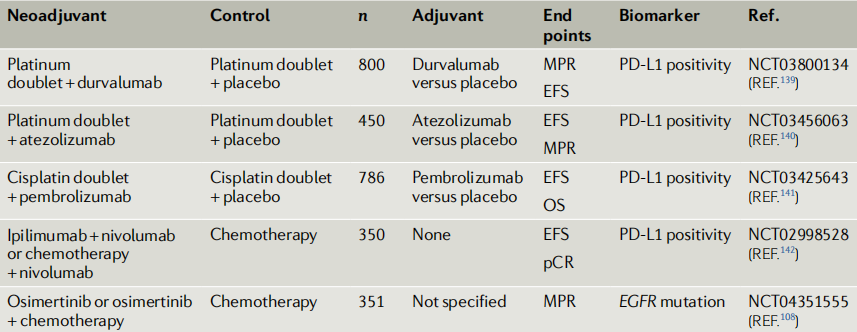
图3:非转移性NSCLC新辅助治疗正在进行的Ⅲ期研究
此外,围手术期免疫疗法与化疗联合应用有望进一步提高早期NSCLC患者的临床疗效。我们知道,化疗可通过杀死肿瘤细胞、改变T细胞与癌细胞的比例、减少肿瘤细胞释放的免疫抑制性物质以及释放抗原进行呈递,从而扩大抗肿瘤疗效,与免疫治疗产生协同作用。化疗还可刺激NSCLC中PD-L1的表达,在化疗的基础上加用免疫治疗可显著改善转移性NSCLC患者的预后。因此早期免疫治疗与化疗联合的探索,如在新辅助治疗中的探索也是未来的方向之一。
由于早期药物研究数据成熟所需时间较长,因此早期可切除NSCLC的药物研究进展速度缓慢,临床研究有必要选择合适的替代终点。根据美国FDA规定,基于可预测临床获益的替代终点所获得的药物研究结果,可以考虑加速批准。在非转移性NSCLC患者手术或放化疗临床研究的meta分析中,DFS作为OS的替代终点在统计学上得到了验证。而在评估治疗机制不同的治疗药物时,如免疫治疗或靶向治疗,这种相关性是否仍然有效目前却尚不清楚。ADAURA研究相关数据(患者接受奥希替尼治疗对比安慰剂DFS显著改善)的公布,也让DFS是否能作为适当的临床研究终点再次引起热议。
当前临床研究证据支持以顺铂为基础的术后辅助化疗或同步放化疗。由于试验设计较为低效、生存终点评估需要较长随访时间以及目前临床研究对于肺癌晚期研究更为关注,因此当前用于Ⅳ期肺癌标准治疗的新型药物在早期疾病应用上的探索进展较为缓慢。替代终点如病理学缓解等的应用,或将有效缩短早期疾病临床研究的时间。2018年,PD-L1单抗度伐利尤单抗获批用于同步放化疗后Ⅲ期肺癌的治疗。自此,针对早期肺癌的靶向治疗与免疫治疗研究快速发展。在不可切除的肺癌患者中,同步放化疗后接受度伐利尤单抗全身性治疗改变了这部分患者的常规临床实践,意义重大。目前,非转移性肺癌的全身性治疗仍在不断发展中,未来让我们拭目以待。
[1] Jamie E. Chaft. et al.,(2021) Evolution of systemic therapy for stages I–III non- metastatic non- small- cell lung cancer . Nature Reviews | Clinical Oncology. https://doi.org/10.1038/s41571-021-00501-4 




 京公网安备 11010502033352号
京公网安备 11010502033352号